|
Boletín de la Sociedad Geológica Mexicana Volumen 71, núm. 2, 2019, p. 429 ‒ 444 http://dx.doi.org/10.18268/ BSGM2019v71n2a12
|
 |
Arqueometría aplicada a la conservación de textiles arqueológicos de fibras celulósicas. Petate y mortaja de un fardo mortuorio de Zimapán, Hidalgo
Judith Gómez González1,*, Luisa Mainou1, Ariana Aguilar Romero3, Galia González Hernández2,
Laura Eugenia Beramendi Orosco2, Luisa Straulino Mainou1, Juan Francisco López Ortiz1
1Coordinación Nacional de Conservación del Patrimonio Cultural, INAH, Xicotencatl y General Anaya s/n, San Diego Churubusco, Coyoacán, C.P. 04120, CDMX, México.
2Laboratorio Universitario de Radiocarbono, UNAM, Instituto de Geofísica, Instituto de Investigaciones Antropológicas e Instituto de Geología, Circuito Exterior, Ciudad Universitaria, Coyoacán, C.P. 04519, CDMX, México.
3Escuela Nacional de Antropología e Historia, Periférico Sur y Calle Zapote, Isidro Fabela, C.P. 14030, CDMX, México.
* This email address is being protected from spambots. You need JavaScript enabled to view it.
Resumen
Se realizaron análisis de datación por carbono catorce y microscopía electrónica de barrido para determinar la edad y el estado de conservación de un petate elaborado con fibras duras y una mortaja de algodón de un fardo mortuorio de Zimapán, Hidalgo. Además, las fibras fueron tratadas con quitosán y polipropilenglicol, tratamiento de conservación innovador, cuyo funcionamiento se evaluó con microscopía electrónica de barrido; así mismo también fueron datadas las fibras después del tratamiento. La datación con radiocarbono indica que tanto el petate de fibras de palma como la mortaja de algodón son prehispánicos de 1022 a 1206 cal d.C; las fibras tratadas dieron edades considerablemente más antiguas (72–418 cal d.C.). La diferencia de edades se debe posiblemente al efecto reservorio, ya que el quitosán se obtiene de los exoesqueletos de crustáceos marinos. Además, los análisis realizados indicaron que el tratamiento para las fibras fue efectivo consolidando, flexibilizando y fumigando las fibras al mismo tiempo.
Palabras clave: Petate, mortaja, datación, radiocarbono, quitosán.
Abstract
Radiocarbon dating and scanning electron microscopy analyses were used to determine the age and conservation state of a palm mat made with hard fibers and a cotton shroud found in a funerary bundle of Zimapán Hidalgo, México. The fibers were also treated with an innovative treatment of chitosan and polypropylene glycol. The treatment was analyzed with a scanning electron microscopy and radiocarbon dating was applied to the treated fibers. The radiocarbon dating showed dates of 1022 a 1206 cal d.C therefore the textiles are prehispanic, and the treated fibers showed an early date (72–418 cal d.C.). This difference could be explained from the reservoir effect in the marine organisms because the chitosan is obtained from the chitin of crustacean’s exoskeletons. The analysis also showed that the treatment for the fibers was effective because the fibers gained consolidation, flexibilization and also microorganisms were killed and removed.
Key words: pal mat, shroud, radiocarbon dating, chitosan.
1. Introducción
Debido a la rareza en el hallazgo de fardos funerarios en buen estado de conservación, los proyectos de conservación y restauración de este tipo de bien cultural conllevan diversos retos tanto en investigación, como en la toma de decisiones respecto a los tratamientos que deben llevarse a cabo.
Uno de los más controversiales y paradigmáticos es en relación a su apertura; para la arqueología la preservación de la información contextual y antropológica es primordial (Pijoan y Mancilla, 2000; Sánchez, 2017; Punzo et al., 2017). La gran mayoría de ellos se ha intervenido en la superficie manteniendo la tridimensionalidad, preservando el complejo sistema de tejidos y mortajas en su disposición original, empleado técnicas de análisis no destructivas para su estudio (Punzo et al., 2017).
No obstante, se tiene conocimiento del caso de un fardo, de un personaje de alto rango en San Juanito, Valle del Santa, en Perú, el cual fue abierto y del que se describen algunas características tecnológicas de los elementos que lo conforman; aunque en el artículo no se profundiza en las medidas y consideraciones de conservación empleadas para dicho caso (Chapdelaine y Pimentel, 2008).
Las circunstancias del caso de estudio del fardo funerario procedente de El Saucillo en Zimapán Hidalgo fueron únicas y favorables para el estudio arqueométrico de todos los componentes del fardo por separado, obteniendo información tecnológica concreta de cada elemento, y así mismo, para sentar las pautas para el tratamiento del conjunto material que lo conforma (Figura 1).
|
|
El fardo mortuorio fue encontrado en un abrigo rocoso en la comunidad “El Saucillo” en lo que hasta antes de 1992 fue la margen norte del Río Tula, a tan solo 5 kilómetros de lo que se conocía como Cañón del Infiernillo, el punto en el que Río Tula y el Río San Juan unen sus cauces para dar nacimiento al Río Moctezuma. Este lugar está en los límites de los estados de Hidalgo y Querétaro, al suroeste de Zimapán, un área que geográficamente pertenece a la Sierra Gorda.
La región tiene un relieve cien por ciento serrano, constituido por mesetas y cañadas kársticas, donde antiguos suelos mesozoicos, convergen con tobas volcánicas y rocas ígneas, formando un paisaje abrupto, en el que predominan los suelos pedregosos además poco profundos como el leptosol y regosol (INEGI, 2009). El clima es Semiseco (Bs) y predomina la vegetación xerófila y los matorrales espinosos, dando como resultado un paisaje árido, cuya temperatura promedio oscila entre los 12° y 20°C, y recibe una precipitación pluvial promedio de 500 mm al año (INEGI, 2009). Si bien las condiciones climáticas y edafológicas de la región no son las más óptimas para el desarrollo de la agricultura, el área de estudio ha tenido una larga ocupación por grupos humanos que se han adaptado a las condiciones de este entorno, variando su modo de vida para aprovechar al máximo sus recursos. Mientras que algunos grupos se especializaron en la caza y la recolección, otros practicaron la agricultura aprovechando el agua de los ríos (Viramontes, 1996).
Las características climáticas y ambientales antes descritas propiciaron la buena preservación del fardo. Su mayor deterioro se debe a causas antrópicas. El bulto mortuorio fue vandalizado por un habitante de la región; destruyendo una porción importante del petate y la mortaja. Los resultados de este acto vandálico fueron los que proporcionaron la oportunidad de estudiarlo y analizarlo en su totalidad e intervenir completamente cada una de las partes que lo componen de manera independiente.
El fardo está compuesto por el esqueleto de un adulto joven de sexo masculino que murió por una hemorragia profusa. Una banda de algodón de cuatro metros de extensión con la que fue atado el cadáver en posición decúbito flexionado. Una mortaja o envoltorio de grandes dimensiones, tres fajas de algodón con las que se amarró el envoltorio y un petate que se sujetó con cuerdas elaboradas con fibras duras.
En este artículo se abordarán los estudios arqueométricos de datación por radiocarbono y microscopía electrónica de barrido que se efectuaron al petate y a la mortaja con la finalidad de establecer información importante como la edad, el estado material antes y después de los procesos de intervención que se realizaron para la conservación de los mismos y su evaluación.
En dichos tratamientos se explora el resultado de la aplicación de materiales de gran versatilidad y escasa documentación en el ámbito de la restauración, como es el caso del quitosán. El quitosán es un producto de la desacetilación de la quitina, generalmente obtenida de los exoesqueletos de los camarones o langostas, cuya fórmula es poli-(b-1/4)-2-amino-2-deoxy-D-glucopyranosa; además es el único polisacárido catiónico natural, en su estructura el nitrógeno se encuentra unido a una amina alifática primaria y origina reacciones como N-acilación y la formación de bases de Schiff. El quitosán también se puede encontrar de forma natural en los hongos, pero siempre en menor proporción que la quitina (Pastor, 2004). Por las características únicas del quitosán, que incluyen biodegradabilidad y no toxicidad, se han encontrado diversas aplicaciones y ha sido empleado y evaluado desde otros ámbitos, tales como: industria biomédica (Berger et al., 2004), farmacéutica (Goycoolea, et al., 2009; Montalvo, 2009; Mármol et al. 2011), procesos industriales (Salazar et al., 2014), agricultura (Mármol et al., 2011), industria textil (Gacén y Gacén, 1996), alimentaria y mucho más recientemente en el ámbito de la conservación de patrimonio cultural.
La investigación respecto de la aplicación de este material para el ámbito de la restauración y conservación es aún incipiente; no obstante, en los ámbitos anteriormente señalados se han realizado análisis y estudios de este material identificando una gama amplia de funciones, desde sus propiedades antibacterianas además fungicidas, removedor de iones metálicos, acción quelante en metales de transición y productos contaminantes, retardante de envejecimiento, inhibidor de oxidación, hasta su empleo como flexibilizante en fibras rígidas y fijación de color en textiles así como muchas otras características.
Su versatilidad ha sido demostrada ampliamente en las industrias del papel y textiles (Myllytie et al., 2009), materiales formados esencialmente por celulosa cuya estructura es similar a la del quitosán, siendo su diferencia principal que teniendo los mismos enlaces β-glicosídicos, el quitosán tiene grupos amino en posición C2 remplazando por los grupos hidroxilo en esta posición de la celulosa. Estos materiales han sido ampliamente estudiados en conjunto para entender sus interacciones y la actividad antimicrobiana que proporciona el quitosán a la celulosa (Lee et al., 1999; Liu et al., 2001; Lim y Hudson, 2004; El-tahlawy et al., 2005; Martínez y de la Orden, 2006).
2. Materiales y métodos
2.1 Descripción de los textiles
2.1.1. Petate
El petate es una pieza rectangular que mide 157 cm de largo por 125 cm de ancho cm que fue usado como envoltorio final de un cadáver. Después de ser cortado y removido quedó fragmentado en 33 pedazos de distintos tamaños y formas.
Está tejido con fibra de palma en sarga transversal 1:2, en sentido diagonal y con remate simple en los orillos. Tiene un diseño elaborado con 11 franjas verticales de 14 cm de ancho tejidas de manera intercalada en “Z” y en “V” y una cenefa perimetral de anchos diferentes para cada lado (Figura 2).
|
|
2.1.2 Mortaja
La mortaja es un textil de algodón de hilo grueso que mide 240 cm de largo por 148 cm de ancho, elaborada en telar de cintura. Está hecho por medio de tres franjas unidas a lo largo por medio de puntada simple; las dos que ocupan los extremos miden 240 cm de largo por 48 cm de ancho, mientras que la central tiene 52 cm de ancho y el mismo largo que las de los extremos.
El lienzo está elaborado con fibra de algodón cruda, hilos con torsión en “Z” y ligamento de taletón, 1 hilo de urdimbre por 2 hilos de trama. Tiene un diseño con decoración de tramas agregadas, conocido como brocado. Al mismo tiempo tiene rombos concéntricos y dos bandas de grecas escalonadas ubicadas en los extremos del lienzo (Figura 3).
|
|
2.2 Estado de conservación y tratamiento
En el momento de realizar el diagnóstico del estado de conservación del petate y la mortaja las fibras se encontraron sumamente sucias, duras, quebradizas, deshidratadas y muy contaminadas por abundantes microorganismos propios de la putrefacción cadavérica y sangre. Por tales circunstancias se eligió utilizar el quitosán ya que por sus características favorece el arrastre de mugre y polvo, elimina microorganismos (hongos y bacterias), consolida las fibras de celulosa dándoles mayor resistencia y flexibilidad y además fija los pigmentos y colorantes.
2.2.1 Preparación del quitosán
Para la preparación del quitosán líquido se utilizó quitosán marca Sigma-Aldrich de bajo peso molecular. Se utilizaron 100 g de quitosán en polvo a lo que se agregó 5000 g de agua y se agitaron continuamente; una vez dispersado y hidratado en el agua se agregaron 30 g de ácido acético de manera gradual para que la dispersión de quitosán en agua se convierta en solución; el pH de la solución se comprobó con tiras indicadoras de pH y dio un resultado de 6.7. La solución resultante se disolvió después en 15000 g de agua. La proporción de quitosán en la solución es de 0.49%. Ambos textiles fueron inmersos en 20 litros de solución de agua destilada con quitosán (preparados como anteriormente se describe) y propilenglicol al 1%, hasta eliminar por completo toda suciedad adherida en la superficie. Después se enjuagaron dos veces con agua destilada y se dejaron secar al aire libre.
2.3 Descripción de la datación por el método de 14c
Las muestras utilizadas para la datación fueron obtenidas de fibras completamente sueltas y que no presentaban entretejido alguno. Estas fibras fueron rescatadas junto con el resto del fardo y fueron aquellas que se desprendieron, rompieron y cortaron al vandalizarlo.
Estas fibras fueron datadas empleando el método de datación por 14C por la técnica de Espectrometría de Centelleo Líquido (ECL) en el Laboratorio Universitario de Radiocarbono-LUR de la UNAM, para ello se obtuvieron 5 g de fibras de algodón pertenecientes a la mortaja (UNAM-1609) y 5 g de fibras del petate (UNAM-1610A) sin tratamientos previos y una tercera muestra de fibras de petate tratadas con quitosán (UNAM-1610B).
Las muestras fueron sometidas a un proceso de limpieza física, bajo lupa y microscopio con ayuda de diferentes tipos de pinzas metálicas; se eliminó en cada una de las muestras contaminantes visibles que pudieran estar aportando otra fuente de carbono. Seguidamente las muestras fueron tratadas químicamente empleando el método convencional AAA (por sus siglas en inglés acid-alkali-acid), el cual consiste en sumergir las muestras en soluciones acidas (ácido clorhídrico 1M por 24 horas) y alcalinas (hidróxido de sodio 0.1M por 4 hrs) en un baño María con agitación a 45°C. Entre cada lavado, con las soluciones mencionadas, las muestras se enjuagaron repetidamente con agua bidestilada hasta alcanzar un pH neutro, finalmente las muestras se secaron en un horno convencional a 50°C por 24 horas.
Las tres muestras, una vez limpias y secas, se transformaron a benceno en el Sintetizador de Benceno del LUR marca Task. Una vez transformadas el benceno de cada muestra se mezcla con un centellador para poder detectar la radiación del 14C contenido en las muestras. El centellador utilizado es un coctel de centelleo compuesto por: 2,5-diphenyloxazole (PPO) + 1,4-Bis(5-phenyl-2-oxazolyl) (POPOP) disueltos en benceno “muerto” grado espectrofotométrico.
El análisis del 14C en el benceno de las muestras se realizó en el ECL de ultra bajo nivel modelo Quantulus 1220 del LUR utilizando viales de teflón con capacidad de 3 mL. El uso de estos viales permite alcanzar una precisión analítica de ± 0.2%, un límite de detección (actividad mínima detectable) de 0.001 y un ruido de fondo menor a 0.16 CPM/g C. Junto con las muestras se analizó el estándar SRM4990C y un blanco (una muestra que no contiene 14C). Cada muestra se analizó por 2500 minutos distribuidos en 50 ciclos de 50 minutos cada uno. El resultado que arroja el espectrómetro corresponde a la cantidad de 14C contenida en cada muestra analizada (muestras problema y estándar) expresada en conteos por minuto (CPM).
Para poder realizar la corrección por el fraccionamiento isotópico es necesario determinar la composición isotópica de 13C. Este análisis se realizó en el Laboratorio de Espectrometría de Masas de Isótopos Estables del Instituto de Geología. Las muestras se analizaron conforme al método de combustión tipo Dumas con Analizador Elemental e interface acoplados a un Espectrómetro de Masas Delta Plus XL con una precisión de 0.2‰.
2.4 Análisis con microscopía electrónica de barrido
Se obtuvieron de ambos textiles cinco muestras representativas del deterioro general antes y después de su intervención. Se observaron en el microscopio de barrido Jeol JM 6460 LV de la Subdirección de Laboratorios y Apoyo Académico del INAH. Las observaciones se hicieron en las siguientes condiciones: Las muestras se recubrieron con oro, se observaron al alto vacío, se utilizaron electrones secundarios a 20 kV y 10 mm de distancia de trabajo.
2.5 Identificación de microorganismos
De acuerdo con Valentín (2010) y Nitiu et al. (2015) es común que los fardos mortuorios sean una fuente de contaminación por contener microorganismos que dañan tanto a los componentes de los bultos funerarios tanto como a la salud de quienes los trabajan y manipulan. Igualmente, estos microorganismos pueden ser una fuente de contaminación importante durante las exposiciones, en las bodegas y en los almacenes de los museos.
Por tal motivo, y sobre todo, para evitar cualquier enfermedad durante el proceso de conservación y restauración de este fardo se tomaron muestras del textil y se enviaron a analizar al laboratorio de Patología Clínica Médica Sur, laboratorio acreditado por el College of American Pathologists.
De acuerdo con el reporte del laboratorio número de orden 0/2828514 las muestras fueron tratadas por medio de cultivo aéreo con medio selectivo.
3. Resultados
3.1. Resultados de la datación por el método de 14c
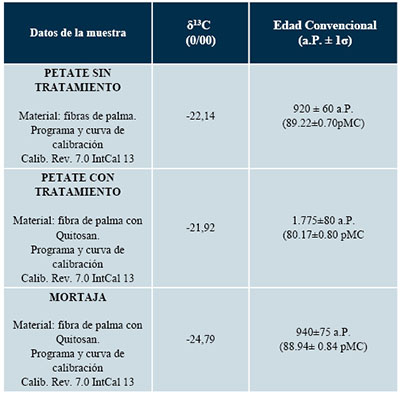
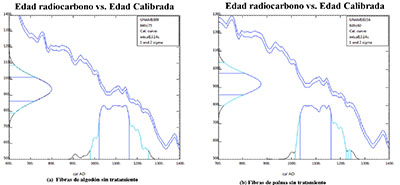
Los resultados de las edades radiocarbónicas convencionales obtenidas para cada una de las muestras analizadas, así como de las edades calibradas, reportadas como intervalos de densidad de probabilidad al 95.4% (2σ), se presentan en la Tabla 1 y en la Figura 7. La calibración se realizó utilizando el programa de calibración Calib Rev. 7.0 (Stuiver y Reimer, 1993) con la curva de calibración IntCal_13 (Reimer et al., 2013).
Las edades radiocarbónicas de las fibras de algodón de la mortaja (UNAM-1609) y las fibras de palma del petate (UNAM-1610A) son estadísticamente iguales con un nivel de confianza del 95%, ubicando este fardo funerario en un intervalo promedio en el calendario que abarca de 1022 a 1206 cal d.C. Sin embargo, la muestra de fibras del petate tratadas con quitosán (UNAM-1610B) arroja una temporalidad mucho más antigua (72–418 cal d.C.) (Tabla 1 y Figura 4).
|
Tabla 1. Resultados de las dataciones por radiocarbón en los materiales estudiados. Se indican datos de la muestra (material, programa y curva de calibración), δ13C, edad convencional (1σ) y edad calibrada (2σ).
pMC: % de Carbono Moderno. Edad Convencional: cálculo de la edad con el factor de corrección por fraccionamiento isotópico. |
|
Figura 4. Resultados de la datación por radiocarbono. (a) Fibras de algodón sin tratamiento; (b) Fibras de palma sin tratamiento; (c) Fibras de petate con quitosán; (d) Edades calibradas expresadas a 2 y calibradas con la curva de calibración IntCal_13 (Reimer, et al., 2013). |
3.2 Resultados del tratamiento
El quitosán empleado en el tratamiento acuoso tuvo un efecto positivo en el arrastre de la mugre y polvo depositados en las fibras, así mismo se pudo comprobar por medio de pruebas mecánicas sencillas que ambos textiles recuperaron fuerza, resistencia, elasticidad y además se rehidrataron las fibras. Así mismo se comprobó que el quitosán es eficiente para eliminar microorganismos.
Además, como otra ventaja de este tratamiento no se apreciaron encogimientos, ni cambios de color.
3.2.1 Petate
Antes de tratamiento
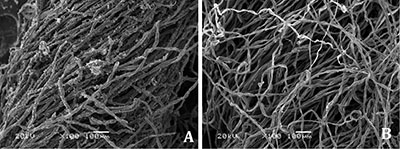
Las imágenes muestran una fibra de petate antes de su tratamiento. En la imagen (Figura 5A), la fibra vegetal además de mostrar la suciedad superficial, se observa que la superficie está microcraquelada, reseca y quebradiza. Igualmente se puede observar que se ha perdido parte de la cutícula dejando expuesta la epidermis muy degradada. A mayores aumentos, se ve una costra de detritus orgánico formada por tierra, restos de hilos de algodón pertenecientes a la mortaja, células sanguíneas, bacterias y microfibras del propio petate (Figura 5B).
|
Foto: Judith Gómez. |
Después de la intervención con quitosán y polipropilenglicol
Las fibras del petate, una vez expuestas al contacto directo con la solución de quitosán, mejoraron en su estado de conservación, como se nota con claridad en las microfotografías. La capa de microorganismos y restos orgánicos del individuo se eliminaron casi en su totalidad. Al mismo tiempo se puede observar que la fibra presenta un aspecto menos reseco y quebradizo, es decir que está más hidratada (Figura 6A y Figura 6B).
|
|
El resultado final, en las fibras de petate, demostró que el tejido había recuperado su flexibilidad y manejabilidad en un 80%, lo que permitió realizar la restauración completa del petate.
3.2.2. Mortaja
Antes de tratamiento
En la imagen de la izquierda se puede observar un cabo de algodón con presencia de suciedad, células sanguíneas y bacterias. Así mismo se puede apreciar como la misma suciedad mantiene a los hilos completamente apelmazados y resecos (Figura 7 A).
|
Figura 7. Imágenes de Microscopía Electrónica de Barrido de la mortaja. (a) Aspecto antes del tratamiento de limpieza. (b) Aspecto después del tratamiento de limpieza. Foto: Judith Gómez. |
Después del tratamiento de limpieza
En esta imagen se puede observar el cambio de aspecto de las fibras después de la limpieza con quitosán. Este producto logró eliminar más del 90% de las bacterias y células sanguíneas (Figura 7B). Igualmente, se puede ver que las fibras están más flexibles e hidratadas.
3.3 Identificación de microorganismos
Se identificaron abundantes bacterias de tipo Basillus pumillus.
4. Discusión
El tratamiento utilizado para la conservación del petate y la mortaja es novedoso ya que el quitosán no se había utilizado en México para el tratamiento de piezas de fibras duras ni hilos de algodón y tampoco hemos encontrado ejemplos en el resto del mundo para el tratamiento de fibras celulósicas en textiles prehispánicos; no obstante, como ya se ha mencionado es una sustancia ampliamente utilizada en la industria textil por las propiedades que aporta.
La mayoría de las propiedades características del quitosán se deben al contenido de grupos amino primarios que hacen que esta sustancia sea un polielectrolito catiónico dada la facilidad de protonación de dichos grupos funcionales. Los grupos amino también son responsables de varias modificaciones en sitios selectivos de la molécula como la formación de bases de Schiff, N-acetilación y alquilación reductiva. En este caso de estudio el quitosán parece sumamente efectivo para tratar fibras celulósicas arqueológicas que se encontraban resecas, quebradizas y poco flexibles, así como con una infestación severa de microorganismos.
Ahora bien, el mecanismo por el cual el quitosán puede consolidar y flexibilizar estas fibras ha sido estudiado en la industria. Los estudios de Myllytie et al. (2009) demuestran que el quitosán se adsorbe en la celulosa por atracciones electrostáticas y que este proceso es dependiente del pH (el pH que al que se utilizó el quitosán en este trabajo fue de 6.7): a pH de 5 el quitosán es adsorbido en la estructura de la celulosa y a partir de un pH de 7 el quitosán forma una cobertura insoluble en la superficie de la celulosa. La adsorción del quitosán a pH de 6.5 es similar al comportamiento a pH de 5. Se adsorbe más quitosán en la superficie de la celulosa porque la carga negativa de la celulosa aumenta, mientras que las cargas positivas del quitosán decrecen con pH más altos. El quitosán adsorbido a pH 5 y pH 6.5 después de enjuagar la celulosa fue de 0.6 mg/m2 y de 1.0 mg/m2 respectivamente. Además, estos autores sugieren la formación de puentes de hidrógeno y otras interacciones químicas además de las electrostáticas.
Siguiendo con ello, se ha señalado que el quitosán reacciona con la celulosa formando iminas conjugadas producidas en la condensación de los grupos amino del quitosán y los grupos carbonilo formando bases de Schiff, incluso en fibras de algodón deterioradas (celulosa oxidada) (Liu et al. 2001, Martínez y de la Orden, 2006).
Entonces, la consolidación de la fibra se logra por la compatibilidad molecular, similitud estructural y atracción electrostática fuerte entre el quitosán además la celulosa de la palma y el algodón devolviendo el fortalecimiento estructural de la fibra, así como la compatibilidad del propilenglicol como flexibilizante de las fibras.
Empero, parecería que la interacción química entre el quitosán y el algodón no es fuerte, ya que en varios trabajos mencionan que con 10 y hasta 50 lavados en textiles de algodón tratados con quitosán las propiedades adquiridas disminuyen (Lim y Hudson, 2003; Gupta y Haile, 2006; Periolatto et al., 2012). Es posible que las modificaciones de la celulosa con el quitosán se den sólo en la superficie de las fibras de algodón ya que el quitosán es una macromolécula que puede no penetrar en toda la fibra (Liu et al., 2001).
No obstante, el hecho de que el quitosán pueda ser removido con lavados es una ventaja en los procesos de conservación y restauración, ya que entre las premisas éticas de esta disciplina está el que los procedimientos sean reversibles o los objetos tratados, retratables; así en caso de ser necesario, el quitosán se puede remover, en parte, de los tejidos con enjuagues en agua destilada. Por lo anteriormente descrito es posible que se disuelva de nueva cuenta la fracción que se une a la celulosa por adsorción eléctrica y puentes de hidrógeno, ya que los enlaces covalentes que forma con la celulosa no se pueden romper con agua.
En otro orden, en los resultados se reporta que no hubo cambio de color a simple vista después del tratamiento, no obstante Martínez y de la Orden (2006) reportan que la celulosa tratada con quitosán tiene un amarilleamiento moderado después de algunas semanas debido a la formación de bases de Shiff. Por ello deberá hacerse, en un futuro, la identificación del cambio de color en materiales celulósicos tratados con quitosán para evaluar este aspecto en el tratamiento realizado aunque no se observe un cambio a simple vista, hay que recordar que la celulosa es blanca mientras que el algodón prehispánico tiende a un color amarillento y las fibras de palma al secar son cafés.
Se conoce un artículo donde se probó una mezcla de quitosán al 2% en agua y en mezcla 1:1 con polietilenglicol 300 al 30% en fibras duras secas (Sánchez et.al., 2017). El artículo reporta que “La inmersión en quitina tampoco fue adecuada, ya que provocó la mayor contracción en las fibras tanto en sentido longitudinal como transversal, lo que deforma grandemente las muestras. Cuando se empleó una mezcla en combinación con el PEG [sic], mejoraron ligeramente las características morfológicas finales, primordialmente, en cuanto a contracción se refiere. Sin embargo, se depositó una película entre los ligamentos del tejido, que cambió de manera considerable el color de la muestra (Sánchez et al. 2017)”.
Observamos varias inconsistencias en el artículo mencionado: se habla de quitina y no quitosán, no obstante, al expresar en el artículo que se utilizó una solución en agua suponemos que se trata de quitosán puesto que la quitina no es soluble en agua; sin embargo, cuando se describe la composición química del material, sí se habla de la composición de la quitina ya que se dice que es similar a la celulosa pero que en vez de un grupo hidroxilo tiene un grupo acetilamina, siendo que el quitosán tiene un grupo amino.
Por otro lado, Sánchez et al. (2017) reportan que con el quitosán hubo contracciones en las fibras, y que la mezcla de quitosán y PEG dejó una película heterogénea en la superficie de la epidermis además de contracción de las células parenquimales asumiendo que fue por contracción de la mezcla quitosán–PEG; el artículo no cuenta con microfotografías de las fibras antes de proceso ni con microfotografías del proceso realizado únicamente con quitosán, así mismo no cuenta con medidas antes y después del tratamiento, por lo que las comparaciones visuales no pueden llevarse a cabo. Una concentración de 2% parece muy alta (recuérdese que la proporción de la solución de quitosán en agua que se utilizó para este trabajo fue de 0.49%), ya que como se dijo anteriormente, la adsorción real del quitosán en la celulosa es, a pH 6.5, de aproximadamente 1gr/m2 por lo que el quitosán restante sí pudo haber formado, al secar, películas en superficie con cierto grado de contracción. Por otro lado, es más probable que la película que se observa en superficie sea de polietilenglicol ya que la concentración que se reporta del 30% es muy alta. Además, en el artículo no se reportan enjuagues en las fibras tratadas; este enjuague superficial hubiera removido las capas formadas por quitosán-PEG. Vemos entonces que los problemas reportados en el artículo no se deben al quitosán en sí mismo ni a la mezcla con PEG, sino al método de aplicación que puede ser mejorado para obtener óptimos resultados.
Por otro lado, el uso de quitosán como agente antimicrobiano en textiles y específicamente en algodón ha sido ampliamente documentado por varios investigadores (Lee et al.,1999; Lim y Hudson 2003, 2004; El-tahlawy et al., 2005; Gupta y Haile 2006; Periolatto et al.,2012).
Son varios mecanismos de acción antimicrobiana propuestospara el quitosán: A) La estructura policatiónica del quitosán interactúa con los componentes aniónicos de la superficie de los microorganismos lo que resulta en cambios en la permeabilidad; así se causa la muerte de la célula induciendo fugas en los componentes intracelulares. B) El quitosán en la superficie de la célula puede formar una membrana polimérica que evita que los nutrientes lleguen al interior de la célula. C) El quitosán de bajo peso molecular entra a la célula, adhiriéndose al ADN inhibiendo la síntesis de RNA y proteínas. D) Como el quitosán puede adsorber las sustancias electronegativas en la célula y flocularlas, perturba las actividades fisiológicas de los microorganismos produciendo muerte celular (El-tahlawy et al., 2005).
Es importantísima esta propiedad del quitosán ya que a la vez que refuerza la celulosa del algodón y la quitina, tiene efectos antimicrobianos y antifúngicos en los materiales, lo que es de suma importancia para las personas que tienen contacto con los bienes culturales. En este caso la bacteria Bacillus pumilus, aunque produce infecciones excepcionalmente, algunas de sus cepas producen hemolisinas, moléculas determinantes de virulencia bacteriana; además se han detectado toxinas eméticas relacionadas a incidentes en alimentos contaminados, etc. (Molina, 2010; Kusmiatun et al., 2015), es por ello por lo que el tratamiento con quitosán provee un factor importante para cuidar la salud del personal que esté en contacto con este tipo de bienes culturales.
Ahora bien, respecto a la datación por radiocarbono de los tejidos sin tratamiento se confirmó que fueron facturados en época prehispánica, en el posclásico, y que pertenecieron a un poblador prehispánico que vivió hace aproximadamente 1000 años. Este individuo fue reconocido por los arqueólogos como perteneciente a un grupo semi nómada. Existe la idea preconcebida de que estos grupos sociales estaban conformados por personas con poca vestimenta y pertenencias simples y sencillas; sin embargo, el estudio de los dos textiles presentados en este trabajo, y los demás artefactos que componen el fardo, demuestra lo contrario para este individuo en particular.
Las elaboradas técnicas de manufactura en los tejidos revelan un conocimiento amplio, muy desarrollado y complejo de las técnicas efectuadas. Implican un adiestramiento y maestría en todo sentido, desde la recolección de las fibras para elaborar los tejidos, los procesos de obtención de fibras, hilado, urdido, teñido y tejido en telar de cintura en el caso del algodón y en el caso de la palma recolección, secado y tejido de fibras obtenidas de las hojas de palma.
Esto, a su vez, involucra tiempo, dedicación y conocimiento para ejecutar cada una de las actividades correspondientes en su obtención. Tanto en el petate como la mortaja se necesitaron varias horas dedicadas en el tejido a mano, tanto en el piso como en el telar de cintura; así, posiblemente, las actividades de los cazadores recolectores de este grupo permitieran contar con tiempo para fabricar este tipo de objetos y es probable que todas estas actividades formaran parte del quehacer femenino como en grupos sedentarios de la misma época o que llegasen por intercambio de bienes.
Es relevante hacer notar la maestría de ejecución en estos objetos que además por el tipo de decoración empleada en cada uno de sus elementos denotan cierto nivel social o status en el ritual de entierro de este individuo.
Con respecto a la datación de la fibra de palma tratada con quitosán y la discordancia en las edades obtenidas para las fibras del petate no tratadas puede decirse que probablemente esté relacionada con el efecto reservorios de los organismos marinos de donde se obtiene el quitosán.
El quitosán se produce a partir de la quitina que es un elemento estructural en el exoesqueleto de los artrópodos en general, pero industrialmente se obtiene de crustáceos marinos como langostas y sobre todo camarones; en estos organismos, aunque contemporáneos, los exoesqueletos pueden arrojar edades aparentes más antiguas que las reales debido al efecto que tiene el reservorio en donde se están desarrollando.
El efecto reservorio de radiocarbono (ΔR) se define como el resultado de la diferente actividad radiocarbónicaradio carbónica que representan los reservorios marino y atmosférico, así como los organismos en equilibrio con ellos, y se expresa como una edad aparente que tiende a envejecer a los organismos marinos respecto a los continentales (Favier Dubois, 2009). La composición isotópica del carbono de los exoesqueletos de los crustáceos refleja la composición isotópica de los carbonatos disueltos en el agua provenientes de diferentes fuentes como puede ser la disolución de las rocas encajonantes y de los carbonatos de las conchas de los moluscos; la actividad de 14C de estos carbonatos es menor que la actividad del 14C en el CO2 atmosférico, ocasionando edades más antiguas que las reales como es el caso de las fibras tratadas con quitosán. Es recomendable, entonces realizar la datación sobre materiales que no han sido tratados químicamente con anterioridad y así evitar incertidumbre en los resultados.
5. Conclusiones
Siendo un trabajo pionero, el resultado de los análisis arqueométricos ha sido muy enriquecedor ya que se ha estudiado cada uno de los elementos del fardo, obteniendo resultados que permitieron realizar intervenciones favorables para la conservación con métodos novedosos y sustentables, preservando gran cantidad de información de la rica técnica de manufactura en los textiles desarrollada por uno de los grupos otomíes asentados en el Valle del Mezquital hace mil años.
El tratamiento con quitosán y propilen glicol resultó efectivo y hace los procesos eficientes y eficaces ya que al mismo tiempo consolida y devuelve la flexibilidad a las fibras utilizadas para fabricar los textiles y elimina microorganismos que no sólo pueden dañar las fibras si son reactivados.
Por otro lado, hay que mencionar que la consolidación con quitosán modificó las edades de radiocarbono, ya que incorpora carbono que no es del objeto. La edad obtenida fue más antigua que la obtenida para los textiles lo que hace pensar en el efecto reservorio que se da en objetos y animales marinos. Además, la datación por radiocarbono de este tipo de material es factible y muy recomendable debido a que son organismos de ciclo de vida corto por lo que representan momentos muy precisos y acotados en el tiempo. Es deseable que los fragmentos representativos de los materiales destinados a la datación no sean tratados químicamente, al menos con productos orgánicos pues se corre el riesgo de alterar la composición isotópica de carbono y generar edades más antiguas o más jóvenes que las reales, por ello, hoy en día parte de la metodología de los análisis arqueométricos implica la toma de muestras antes de cualquier tratamiento que pueda perturbar la composición o estado de conservación de los artefactos.
No obstante, es necesario continuar investigando sobre el efecto de ciertas sustancias químicas, en particular el quitosán por su efectividad en los tratamientos de conservación, para adecuar los protocolos de limpieza en muestras orgánicas que ya han sido tratadas y que se tenga interés en datar.
En este trabajo se establece un precedente sobre las decisiones al establecer métodos de intervención poco ortodoxos para el estudio y tratamiento de este tipo de objetos ya que por su naturaleza suelen ser focos de infección, con microorganismos en estado latente, que pueden activarse con un tratamiento acuoso o bien al estar almacenados en depósitos con condiciones ambientales idóneas para su desarrollo. Su intervención requiere de un conocimiento pleno del objeto y acciones de conservación bien establecidas evitando, entre otras cosas, el desarrollo de problemas de salud para las personas que intervienen el objeto y que custodian este tipo de bienes en museos o bodegas.
Numerosas líneas de investigación se despliegan a partir de esta labor, por ejemplo, la documentación y estudio sobre petates tejidos con palma a nivel nacional, el análisis de deterioro en fibras duras, aportaciones nuevas en técnicas de manufactura textil, uso de biocidas no tóxicos, la evaluación del quitosán y el efecto reservorio que suponemos afecta la edad de los artefactos tratados, así como la evaluación del cambio de color con el tratamiento por medio de colorimetría.
Agradecimientos
LUR-LANGEM agradece el financiamiento del CONACyT (Proyecto 294889). Gerardo Villa Sánchez. Imágenes de MEB del petate. Laboratorio de Microscopía Electrónica de Barrido. Subdirección de Laboratorios y Apoyo Académico del INAH. Mario Monrroy. Imágenes de MEB de la mortaja. Laboratorio de Microscopía Electrónica de Barrido. Subdirección de Laboratorios y Apoyo Académico del INAH.
Referencias
Berger, J., Reist, M., Mayer, J.M., Felt, O., Peppas, N.A., Gurny, R., 2004, Structure and interactions in covalently and ionically crosslinked chitosan hydrogels for biomedical applications: European Journal of Pharmaceutics and Biopharmaceutics, 57, 19–34.
Chapdelaine, C., Pimentel, V., 2008, Personaje de alto rango en San Juanito, valle de Santa. en Makowski, K., Pillsbury, J., and Franco Jordán, R. G. (eds.), Señores de los reinos de la luna: Lima, Banco de Crédito del Perú, 248–253.
El-tahlawy, K., El-bendary, M.A., Elhendawy, A.G., Hudson, S.M., 2005, The antimicrobial activity of cotton fabrics treated with different crosslinking agents and chitosan: Carbohydrate Polymers, 60, 421–430.
Favier Dubois C.M., 2009, Valores de Efecto Reservorio Marino para los últimos 5000 años obtenidos en concheros de la Costa Atlántica Norpatagónica (Golfo San Matías, Argentina): Magallania, 37(2), 139–147.
Gacén Guillén, J.; Gacén Esbec, I., 1996, Quitina y quitosano, Nuevos materiales textiles: Boletín del Instituto de Investigación Textil y de Cooperación Industrial, 110, 67–71.
Goycoolea, F., Remuñán López, C., Alonso, M., 2009, Nanopartículas a base de polisacáridos Quitosano, en Vila Jato, J.L. (ed.), Nanotecnología Farmacéutica: Realidades y posibilidades farmacoterapéuticas: Madrid, Real Academia Nacional de Farmacia, 103–113.
Gupta, D., Haile, A., 2006, Multifunctional properties of cotton fabric treated with chitosan and carboxymethyl chitosan: Carbohydrate Polymers, 69, 164–171.
Instituto Nacional de Estadística y Geografía e Informática (INEGI), 2009, Prontuario de información geográfica municipal de los Estados Unidos Mexicanos, Zimapán, Hidalgo, México (en línea): México. D.F., Secretaría de Programación y Presupuesto, Instituto Nacional de Estadística, Geografía e Informática, disponible en < http://www3.inegi.org.mx/contenidos/app/mexicocifras/datos_geograficos/13/13084.pdf >, consultado en junio 2017.
Kusmiatun, A., Rusmana, I., Budiarti, S., 2015, Characterization of Bacteriophage Specific to Bacillus pumilus from Ciapus River in Bogor, West Java, Indonesia: HAYATI Journal of Biosciences, 22 (1), 27–33.
Lee, S., Cho, J.S., Cho, G., 1999, Antimicrobial and Blood repellent finishes for cotton and nonwoven fabrics based on Chitosan and fluoropolymers: Textile Research Journal, 69 (2), 104–112.
Lim, S.H., Hudson, S.M., 2003, Review of chitosan and its derivatives as antimicrobial agents and their uses as textile chemicals: Journal of macromolecular Science, Part C: Polymer Reviews, 43 (2), 223–269.
Lim, S.H., Hudson, S.M., 2004, Synthesis and antimicrobial activity of a water-soluble chitosan derivative with a fiber reactive group: Carbohydrate Research, 339, 313–319.
Liu, X.D., Nishi, N., Tokura, S., Sakairi, N., 2001, Chitosan coated cotton fiber: preparation and physical properties: Carbohydrate Polymers, 44, 233–238.
Mármol, Z., Páez, G., Rincón, M., Araujo, K., Aiello, C., Chandler, C., & Gutiérrez, E., 2011, Quitina y Quitosano polímeros amigables. Una revisión de sus aplicaciones: Revista Tecnocientífica URU, 1 , 53–58.
Martínez Urreaga, J. y de la Orden, M.U., 2006, Chemical interactions and yellowing in chitosan treated cellulose: European Polymer Journal 42, 2606–2616.
Molina Hidalgo, A., 2010, Selección y caracterización de la patogenicidad de una cepa de Bacillus pumilus, activa contra la mosca de la fruta del mediterráneo, Ceratitis capitata (Diptera: Tephritidae) : Granada, Universidad de Granada, Instituto de Biotecnología, tesis doctoral, 251 p.
Montalvo Aique, P.L., 2009, Aplicaciones farmacéuticas del quitosán: Lima, Universidad Nacional de Ingeniería, tesis de licenciatura, 65 p.
Myllytie, P., Salmi, J., Laine, J., 2009, The influence on pH on the adsorption and interaction of chitosan with cellulose: BioResources, 4, 1647–1662.
Nitiu, D.S., Mallo, A.C., Elíades, L.A., Saparrat, M.N., Vazquez, H.R., 2015, Monitoreo de la carga fúngica ambiental y de otros bioaerosoles en un depósito de restos momificados del NOA del Museo de la Plata (Argentina): un estudio de caso: Boletín de la Sociedad Argentina de Botánica, 50 (4), 427–436.
Pastor de Abram, A., 2004, Quitina y Quitosano: obtención, caracterización y aplicaciones: Peru, Pontificia Universidad Católica de Perú, 312 p.
Periolatto, M., Ferrero, F., Vineis, C., 2012, Antimicrobial chitosan finish of cotton and silk fabrics by UV-curing with 2-hydroxy-2-methylpropane-1-one: Carbohydrate Polymers, 88, 201–205.
Pijoan Aguadé, C. M., Mancilla Lory, J., 2000, La cueva de la Candelaria: bultos mortuorios y materiales: Chungará, Revista de Antropología Chilena, 32 (2), 211-215.
Punzo Díaz, J.L., Gastélum-Strozzi, A., Peláez Ballestas, I., Zarco Navarro, J., 2017, Estudio arqueológico no invasivo mediante la reconstrucción virtual tridimensional de ocho urnas cinerarias prehispánicas de la Tierra Caliente michoacana: Intervención, Revista Internacional de Conservación, Restauración y Museología, 16, 31–42.
Reimer, P.J., Bard, E., Bayliss, A., Beck, J.W., Blackwell, P.G., Bronk Ramsey, C., Buck, C.E., Cheng, H., Edwards, R.L., Friedrich, M., Grootes, P.M., Guilderson, T.P., Haflidason, H., Hajdas, I., Hatté, C., Heaton, T.J., Hoffmann, D.L., Hogg, A.G., Hughen, K.A., Kaiser, K.F., Kromer, B., Manning, S.W., Niu M., Reimer, R.W., Richards, D.A., Scott, E.M., Southon, J.R., Staff, R. A., Turney, C. S. M., Van der Plicht, J., 2013, Int Cal13 and Marine13 Radiocarbon Age Calibration Curves, 0–50,000 Years cal BP: Radiocarbon, 55 (4), 1869–1887.
Salazar-Leyva, J.A., Lizardi-Mendoza, J., Ramírez-Suarez, J.C., García-Sánchez, G., Ezquerra-Brauer, J.M., Valenzuela-Soto, E.M., Carvallo-Ruiz, M.G., Lugo-Sánchez, M.E., & Pacheco-Aguilar, R, 2014, Utilización de materiales a base de quitina y quitosano en la inmovilización de proteasas: efectos en su estabilización y aplicaciones: Revista Mexicana de Ingeniería Química, 13(1), 129–150.
Sánchez Valenzuela, G.M., 2017, La conservación de dos fardos funerarios provenientes de contextos arqueológicos: El caso de la cueva del Lazo, Ocozocoautla, Chiapas y la cueva de la Candelaria, Torreón, Coahuila, México, en Bjerregaard, L. y Peters, A. (eds.) PreColumbian Textile Conference VII / Jornadas de Textiles PreColombinos VII: Lincoln, NE: Zea Books, 405–414.
Sánchez Valenzuela, G. M.; Alonso Olvera, A.; Escalante Hernández, M. F., 2017, Estudio comparativo de sistemas de consolidación y flexibilización (almidón-PEG, quitina-PEG y lactitol-PEG) para la conservación de objetos de fibras duras provenientes de contextos arqueológicos secos y húmedos en México: Intervención, 15, 5–21.
Stuiver M. y Reimer P.J., 1993, Extended 14C data base and revised CALIB 3.0 14C age calibration program: Radiocarbon, 35 (1), 215–230.
Valentín Rodrigo, N., 2010, El biodeterioro de las colecciones textiles. Pautas para su control y prevención, en Subdirección General de Publicaciones, Información y Documentación (ed.), Jornadas Internacionales de Conservación de tejidos procedentes de contextos funerarios: España, Ministerio de Cultura, 89–92.
Viramontes, C.,1996, La conformación de la frontera chichimeca en la marca del Río San Juan en: Crespo, A.M., Viramontes, C. (eds.) Tiempo y territorio en arqueología, el centro-norte de México: México, Instituto Nacional de Antropología e Historia, 23–35.
Manuscrito recibido: Enero 10, 2018.
Manuscrito corregido: Abril 20, 2018.
Manuscrito aceptado: Mayo 3, 2018.